
PNU 리서치
- 메인으로 이동
- 연구/산학
- PNU 리서치

의과대학 융합의과학과 이동준(사진) 교수팀이 소포체 막단백질 SURF4의 기전을 밝혀 골수성 백혈병의 특이적인 세포사멸 원인을 규명함으로써, 골수성 백혈병의 표적치료에 새로운 계기를 마련했다.
‘급성 골수성 백혈병’은 성인의 급성 백혈병 중 가장 흔한 형태다. 급성 백혈병의 65%를 차지하며, 골수성 백혈구의 분화 단계 중 초기 단계에 있는 조혈줄기세포*(Hematopoietic stem cell) 및 조혈전구세포**(Hematopoietic progenitor cell)에 암적인 변이가 발생해 과도한 분열이 일어나고, 이것이 골수 내에 축적돼 말초혈액에 골수아세포***(myeloblast)가 나타나게 된다. 환자들의 절반은 치료를 받았음에도 5년 생존율이 낮은데, 그 이유는 치료법에 대한 환자들의 저항성이 쉽게 발생해 이에 따른 표적치료제의 개발 및 적용이 매우 어렵기 때문이다.
* 조혈줄기세포(Hematopoietic stem cell): 혈액세포를 우리 몸에서 만들 수 있는 최상위 단계에 있는 성체줄기세포.
** 조혈전구세포(Hematopoietic progenitorcell): 조혈줄기세포가 분화해 분열이 빠른 성체줄기세포 아래 단계에 있는 전구세포.
*** 골수아세포(myeloblast): 과립 백혈구의 미성숙세포 형태이며, 이 세포가 성숙해 골수성 백혈구가 됨.
최근 이동준 교수 연구팀은 이 골수성 백혈병을 표적치료할 수 있는 실마리를 찾아 관심을 모으고 있다.
골수성 백혈병의 특이적 세포사멸을 유도할 수 있는 소포체 막단백질인 써프4(SURF4)를 찾은 것인데, SURF4가 골수성 백혈병에서 STING-STAT6 신호전달체계 특이적 활성조절을 통한 세포사멸 유도조절함을 처음으로 발견해냈다.
‘써프4(SURF4)’는 소포체-골지에서 세포 수송 전달을 조절하는 것으로 알려진 단백질로, 지금까지 보고된 관련 연구들에서 골수성 백혈병에서 SURF4 발현에 대한 구체적인 보고는 없었다. 이번에 연구팀이 처음으로 골수성 백혈병 환자세포에서 SURF4가 특이적으로 높게 발현됨을 발견한 것이다.
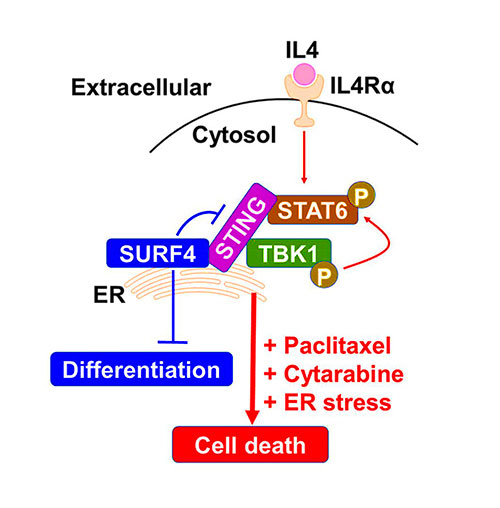
<소포체에 위치한 SURF4 단백질을 이용한 골수성 백혈병 표적치료 모식도>
이번 연구는 SURF4 단백질이 혈액암에서 STING-STAT6 신호전달체계의 활성을 특이적으로 억제함으로써 세포사멸을 조절한다는 것을 밝혀,
혈액암에서 신규 바이오마커 및 유전자치료제로서 개발될 수 있는 발판을 마련했다.
또한 연구팀은 항암제인 파크리탁셀(Paclitaxel) 및 싸이타라빈(Cytrarabine) 병용 투여를 통한 세포사멸 극대화를 유도했다.
나아가 연구팀은 SURF4가 골수성 백혈병 세포의 분화를 억제한다는 흥미로운 사실도 확인했다. 또한 SURF4가 항암 유전자인 STING-STAT6 신호전달체계의 활성을 특이적으로 억제함으로서 세포사멸을 유도함을 관찰했다.
이번 연구는 골수성 백혈병에서 세포사멸 기전을 규명함으로써, 신규 바이오마커 및 유전자치료제로서 개발될 수 있는 발판을 마련했다.
연구 책임을 맡은 이동준 교수는 “이번 연구 결과를 통해 SURF4가 골수성 백혈병의 세포사멸 유도를 설명해 줄 핵심인자이며, 잠재적인 골수성 백혈병 표적치료의 계기가 될 수 있음을 보였다”고 밝혔다.
해당 연구를 실은 논문은 종양생물학 분야의 세계적인 권위지인 『캔서 커뮤니케이션즈(Cancer Communications)』 2022년 11월 6일자 온라인에 게재됐다. 연구는 융합의과학과 이동준 교수가 교신저자, 김자영 연수연구원이 제1저자로 진행했다.
- 논문 제목: Novel endogenous endoplasmic reticulum transmembrane protein SURF4 suppresses cell death by negatively regulating the STING-STAT6 axis in myeloid leukemia (신규 소포체 막단백질 SURF4의 골수성 백혈병에서 STING-STAT6 신호전달체계 활성조절을 통한 세포사멸 조절 기전 연구)
- DOI: 10.1002/cac2.12390
- 논문 링크: https://onlinelibrary.wiley.com/doi/10.1002/cac2.12390
이번 연구는 한국연구재단이 추진하는 신진후속 중견연계, MRC 선도지원센터(암세포 다양성 분자제어 연구센터) 지원 사업으로 수행했다.
[Abstract]
One hallmark of acute myeloid leukemia (AML) that is shared across genetic subtypes is that leukemic myeloblasts are arrested at an immature and self-renewing stage of development. Differentiation is associated with a reduction in leukemic cell burden and leukemia stem cells as well as improved survival. In this study, we report that the endogenous endoplasmic reticulum (ER) transmembrane protein, surfeit 4 (SURF4), inhibits apoptosis and suppresses myeloid differentiation by negatively regulating the stimulator of interferon genes (STING) and signal transducer and activator of transcription 6 (STAT6) functions in myeloid leukemic cells. The recently described cargo receptor SURF4 protein was discovered via in silico screening of patients with cancer. We found that, by modulating SURF4 levels, animal survival was affected in the tumorigenic model. Single-cell RNA-sequencing analysis revealed that the expression of SURF4 was significantly increased in patients with AML, suggesting that it is involved in the pathogenesis of hematological malignancies. We further investigated the function of SURF4 and reported that its inhibition promotes apoptosis via activation of the STING-STAT6 axis in leukemic cells. Moreover, silencing SURF4 inhibited cell growth and increased apoptosis in leukemic cells. In addition, we also observed the enhancement of apoptosis by paclitaxel in the absence of SURF4 in leukemic cells. SURF4 induced apoptosis via the accumulation of reactive oxygen species, which activated ER stress response. Reduced SURF4 expression was capable of triggering myeloid differentiation in vitro and in vivo in murine and human leukemic cell models. Moreover, we found that interleukin 4-dependent pSTAT6 and/or STING activation-induced apoptosis was increased in SURF4-silenced leukemic cells. Collectively, we demonstrated that the novel endogenous ER transmembrane protein, SURF4, inhibits cell death and suppresses myeloid differentiation by negatively regulating STING and STAT6 functions in myeloid leukemic cells. We propose that the inhibition of SURF4 may be used as a potential therapeutic strategy for the treatment of hematological malignancies.
* Reference
- Authors: Jayoung Kim, Dongjun Lee(School of Medicine, Pusan National University)
- Title of original paper: Novel endogenous endoplasmic reticulum transmembrane protein SURF4 suppresses cell death by negatively regulating the STING-STAT6 axis in myeloid leukemia
- https://onlinelibrary.wiley.com/doi/10.1002/cac2.12390
- Journal: Cancer Communications
- DOI: 10.1002/cac2.12390
