
PNU 리서치
- 메인으로 이동
- 연구/산학
- PNU 리서치

분자생물학과 장세복 교수팀이 종양 억제 단백질인 p53과 징크 핑거 단백질* ZNF568 간의 상호작용을 규명해 새로운 항암제 개발 가능성을 제시했다.
* 징크 핑거 단백질(Zinc finger protein): 단백질의 접힌 부분을 안정시키기 위해 하나 이상의 아연 이온(Zn2+)이 존재하는 작은 구조 단백질 모티프.
p53과 ZNF568은 세포가 에너지를 만드는 중요한 과정에 관여하는 SCO2(Synthesis of cytochrome C oxidase 2)*라는 단백질의 생성을 막는다. 이로 인해 시토크롬 c 산화효소 활성이 감소하고 에너지 저장 분자를 합성하는 미토콘드리아 산화적 인산화**가 저해되는 것으로 확인됐다. 하지만, p53과 ZNF568 단백질 간 상호작용에 관한 분자 메커니즘은 여전히 규명되지 않아, 이번에 연구팀에서 이를 뒷받침할 구조생물학 연구를 수행한 것이다.
* SCO2(Synthesis of cytochrome C oxidase 2): 미토콘드리아에서 중요한 역할을 하는 단백질 중 하나. 시토크롬 c 산화효소(cytochrome c oxidase)라는 효소 복합체의 조립과 기능에 중요한 역할을 함. 시토크롬 c 산화효소는 미토콘드리아의 전자전달계의 마지막 단계에서 작용하며, 이 단계에서 전자를 산소로 전달해 물을 생성하고, 이 과정에서 방출된 에너지를 사용해 ATP(에너지 저장 분자)를 합성하는 데 기여함.
** 미토콘드리아 산화적 인산화: 전자전달과 화학삼투를 통한 ATP의 합성과정.
세포는 에너지를 두 가지 방법으로 만든다. 하나는 ‘혐기성 당분해’라고 해서 산소 없이 당을 분해하는 방법이고, 다른 하나는 ‘미토콘드리아 산화적 인산화’라고 불리는 방법으로 산소를 사용해 에너지를 만든다. 대부분의 암세포는 첫 번째 방법으로 에너지를 만드는 것으로 여겨져 관련 항암 연구가 이뤄져 왔는데, 최근의 다양한 연구에 따르면 암세포가 실제로 총 에너지의 60%는 혐기성 당분해로 만들고 나머지 40%를 미토콘드리아 산화적 인산화에 의해 생성함이 밝혀졌다.
이러한 결과는 두 번째 방법, 즉 미토콘드리아 산화적 인산화를 조절하는 방법 또한 알아낸다면 암세포를 더 효과적으로 치료할 수 있을 것이라는 전망을 낳으며 이 과정을 직접 표적하는 연구가 주목받고 있다.
p53과 ZNF568 단백질은 함께 작용해서 세포의 에너지 생성에 관여하는 SCO2 단백질을 억제하고, 이로 인해 미토콘드리아에서 에너지를 만드는 과정이 줄어들게 된다. 이 과정이 줄어들면 암세포의 에너지 생성이 방해를 받아 성장하는 데 문제가 생길 수 있다. 이번 연구는 이 두 단백질이 어떻게 함께 작용하는지 3차원 구조로 보여주는 첫 번째 연구다. 이 구조를 알면 새로운 항암제를 개발하는 데 중요한 정보를 얻을 수 있을 것으로 기대된다.
종양 억제 단백질 p53은 여러 스트레스 신호에 반응해 암의 발생 및 진행을 억제하는 데 중요한 역할을 할 뿐만 아니라, 에너지 대사 및 산화적 인산화 조절을 통해 암세포 대사 경로를 조절할 수 있다는 새로운 기능이 밝혀졌다. 대표적으로 p53은 시토크롬 c 산화효소(Cytochrome c oxidase) 를 구성하는 SCO2 전사를 조절해 미토콘드리아 산화적 인산화를 조절한다.
p53 단백질은 사량체(4개의 분자가 모여 있는 형태)를 형성해 DNA와 결합하는 것으로 알려져 있는데, 이번 연구를 통해 이러한 p53 단백질이 ZNF568 단백질과 복합체를 형성할 때는 DNA와 결합할 때와는 다른 구조적 형태를 보이는 것으로 확인됐다.(cryo-EM 구조/ 그림 오른쪽)
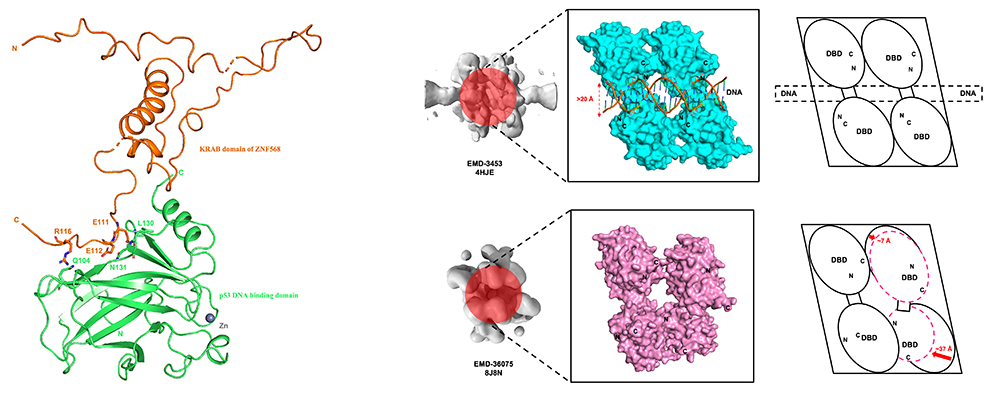
【p53-ZNF568 복합체 구조(왼쪽) 및 복합체 형성에 따른 p53-DNA 결합 메커니즘 변화(오른쪽)】
- 왼쪽: p53 DNA binding domain(DBD) 및 ZNF568 Krüppel-associated box domain(KRAB) 복합체의 구조를 나타냄.(X-선 결정학 구조)
- 오른쪽: 현재 알려진 바에 의하면 p53 단백질은 사량체를 형성해 DNA와 결합함.
이번 연구를 통해 이러한 p53 단백질이 ZNF568 단백질과 복합체를 형성할 때는
DNA와 결합할 때와는 다른 구조적 형태를 보이는 것으로 확인됨.(cryo-EM 구조)
이번 연구를 통해 규명된 구조는 p53과 ZNF568 단백질 복합체에 대한 최초의 3차원 구조로, 향후 국내외 연구자들에게 이에 대한 정보를 제공해 관련 연구에 활용될 수 있을 전망이다.
이번 연구는 SCO2 전사 억제 및 미토콘드리아 산화적 인산화 저해에 관여하는 종양 억제 단백질 p53과ᅠKruppel-type C2H2 징크 핑거 단백질 ZNF568 간 상호작용에 대한 분자 메커니즘을 규명함으로써ᅠ암세포의 미토콘드리아 산화적 인산화, 즉 암세포의 대사 과정을 표적하는ᅠ새로운 항암제 개발 가능성을 제시했다.
해당 연구는 한국연구재단 세종과학펠로우십 및 기본연구 지원을 받아, 장세복 분자생물학과 교수가 교신저자, 생명시스템연구소 한창우 연수연구원이 제1저자, 정미숙 전임연구원이 공동저자로 수행했다.
이번 연구는 국제학술지 『International Journal of Biological Macromolecules』 6월 27일자에 게재됐다.
- 논문 제목: Influence of the Interaction between p53 and ZNF568 on Mitochondrial Oxidative Phosphorylation(미토콘드리아 산화적 인산화에 대한 p53과 ZNF568 사이의 상호작용의 영향)
- DOI: https://doi.org/10.1016/j.ijbiomac.2024.133314
* 상단 인물사진: 오른쪽부터 장세복 교수, 한창우 연수연구원
[Abstract]
The tumor suppressor p53 plays important roles in suppressing the development and progression of cancer by responding to various stress signals. In addition, p53 can regulate the metabolic pathways of cancer cells by regulating energy metabolism and oxidative phosphorylation. Here, we present a mechanism for the interaction between p53 and ZNF568. Initially, we used X-ray crystallography to determine the irregular loop structure of the ZNF568 KRAB domain; this loop plays an important role in the interaction between p53 and ZNF568. In addition, Cryo-EM was used to examine how the p53 DBD and ZNF568 KRAB domains bind together. The function of ZNF568 on p53-mediated mitochondrial respiration was confirmed by measuring glucose consumption and lactate production. These findings show that ZNF568 can reduce p53-mediated mitochondrial respiratory activity by binding to p53 and inhibiting the transcription of SCO2.
* Reference
- Authors(Pusan National University): Dr. Chang Woo Han(Institute of Systems Biology), Prof. Se Bok Jang(Department of Molecular Biology)
- Title of original paper: Influence of the Interaction between p53 and ZNF568 on Mitochondrial Oxidative Phosphorylation
- Journal: International Journal of Biological Macromolecules
