
PNU 리서치
- 메인으로 이동
- 연구/산학
- PNU 리서치
의생명융합공학부 김병수 교수 연구팀이 좁아진 뇌혈관의 실제 구조와 내부 흐름을 그대로 재현한 3D 바이오프린팅 인공 뇌혈관 모델을 개발해, 뇌졸중·치매·혈관염 등 주요 뇌혈관 질환 연구와 약물 평가 분야에 새로운 가능성이 제시됐다.
‘뇌혈관 협착’은 신경혈관 질환의 주요 원인으로, 협착 부위의 비정상적 혈류가 내피세포를 자극해 염증과 병변을 유발한다. 하지만 기존 실험 모델은 체외에서 이런 병리적 환경을 재현하기 어려워 질환 연구와 약물 평가에 한계가 있었다.
이에 연구팀은 뇌혈관 협착 부위를 모사해 정밀하게 프린팅하고, 그 내부에 내피세포를 배양해 실제와 유사한 환경을 형성했다. 협착 뇌혈관의 구조와 유체역학적 특성을 모사할 수 있도록 점탄성과 재형성력을 높인 ECM(세포외기질)* 기반 하이브리드 바이오잉크를 개발하고, 내장형 3D 동축(同軸) 바이오프린팅 기술을 활용해 내벽, 외벽, 혈류 공간을 동시에 구현해 내경 250~500 ㎛(마이크로미터, 0.001㎜)의 협착 혈관 모델을 제작했다.
* ECM(Extracellular Matrix, 세포외기질): 세포가 자라고 기능할 수 있는 지지 구조물로서, 3D 바이오프린팅 모델에서 혈관 구조 형성과 생리학적 반응 유도에 중요한 역할을 한다.
특히, 돼지 유래 혈관 탈세포화 ECM(vascular dECM)에 콜라겐과 알지네이트를 혼합한 하이브리드 바이오잉크를 개발해, 기계적 강도를 약 65배 향상시켰다. 기존의 ECM 단독 바이오잉크는 프린팅 후 수축 및 붕괴 문제가 있었으나, 콜라겐이 구조적 수축을 억제하고 알지네이트가 빠른 겔화를 유도함으로써 안정적인 혈관 내강을 유지할 수 있었다.
* 혈관 유래 탈세포화 ECM(VdECM): 돼지 대동맥 조직에서 유래한 탈세포화 생체재료로, 콜라겐·엘라스틴·글리코사미노글리칸(GAGs) 등 주요 세포외기질 성분이 풍부하게 보존돼 있다.
모델 제작 후에는 CFD(Computational Fluid Dynamics) 기반 시뮬레이션으로 협착 혈관 내 병리적 흐름 특성을 분석했다. 그 결과, 미세입자인 형광 마이크로비드를 이용한 실제 투과성 실험과 일치했으며, 협착 부위에서의 난류 발생과 재순환 영역이 실시간으로 시각화됐다.
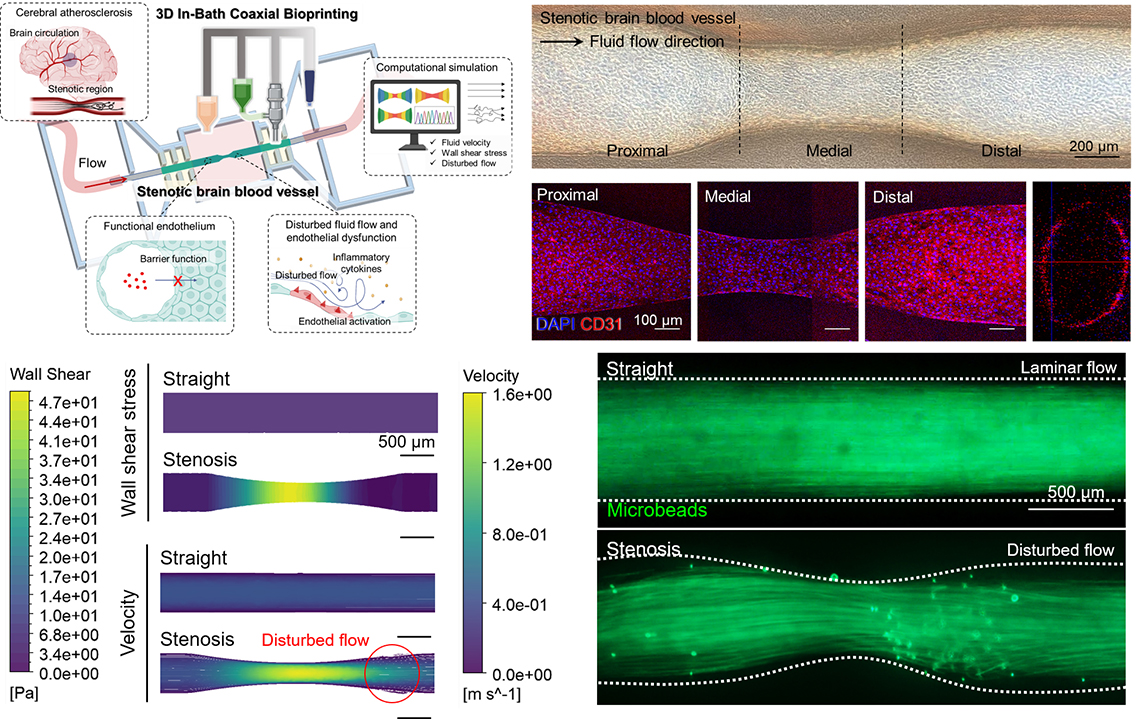
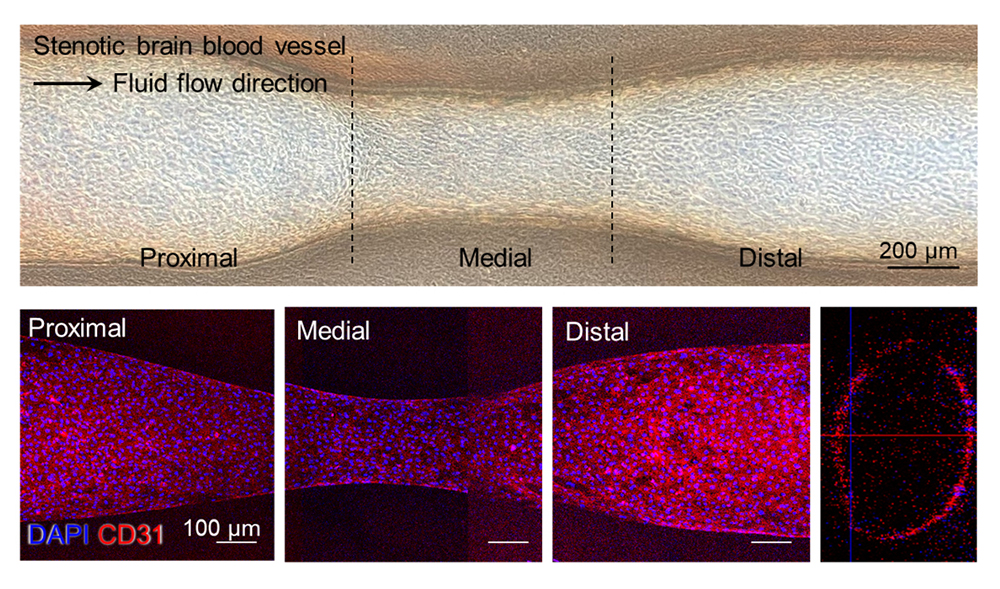
【3D 바이오프린팅 기반 협착성 뇌혈관 모델의 제작 및 내피 반응 시각화】
그림은 이번 연구에서 개발한 협착성 뇌혈관 모델의 제작 과정과 주요 특징을 보여준다.
3D 동축 바이오프린팅 기술을 통해 병리적 협착 구조를 구현하고, 이를 통해 정상과 교란 유동 환경에서의 내피세포 반응 차이를 모사했다.
또한, 실제 제작된 뇌혈관 칩 시스템과 내피세포(HUVEC 및 HBMEC)의 부착 및 성장 과정을 시각적으로 제시함으로써 기능성 혈관 내피 형성을 입증했다.
제작된 혈관 구조 내에 인간 뇌혈관 내피세포(HBMEC)와 제대정맥 내피세포(HUVEC)를 배양한 결과, CD31, ZO-1, VE-cadherin 등 내피세포 접합 단백질이 고르게 발현됐으며, 분자량에 따른 투과성 차이를 나타내는 등 생리학적으로 기능성 있는 혈관 내피로 파악됐다.
구조뿐만 아니라 혈류에 따라 변하는 염증 반응까지 재현했다는 점이 주목된다. 협착 부위에서 혈류가 왜곡되고 압력이 달라지면서 염증성 접착분자인 ICAM-1과 VCAM-1의 발현이 각각 약 2.2배, 1.5배까지 높아졌는데, 이는 실제 동맥경화 등의 염증 반응과 유사한 결과다. 연구팀의 모델이 혈류 유도성 염증 반응을 정량적으로 재현할 수 있음을 보여준다.
김병수 교수는 “이번 연구는 병리적 혈류 환경을 체외에서 구현하고, 이에 따른 내피세포의 염증 반응까지 정량적으로 분석할 수 있는 새로운 플랫폼을 제시했다는 점에서 의의가 크다”며 “향후 혈관 질환의 기전 연구는 물론, 약물 반응 평가와 맞춤형 치료 전략 개발에도 폭넓게 활용될 수 있을 것”이라고 설명했다.

【왼쪽부터 김병수 교수, 최민주 석사졸업생】
이번 연구는 과학기술정보통신부 재원의 한국연구재단 바이오의료기술개발사업과 우수신진연구사업, 산업통상자원부 알키미스트 프로젝트의 지원을 받았다. 부산대 의생명융합공학부 김병수 교수와 포항공대 기계공학부 조동우 교수가 공동 교신저자, 부산대 의생명융합공학부 최민주 석사졸업생(현 한국재료연구원 소속)과 포항공대 기계공학과 박원빈 박사(현 티센바이오팜 소속)가 공동 제1저자로 수행했다.
혈류역학 기반 뇌혈관 질환 모델링의 새로운 가능성을 제시한 이번 연구는 생체재료 및 조직공학 분야에서 권위 있는 국제 학술지 『어드밴스드 펑셔녈 머티리얼즈(Advanced Functional Materials』 6월 30일자에 게재됐다.
- 논문 제목: Embedded 3D-Coaxial Bioprinting of Stenotic Brain Vessels with a Mechanically Enhanced Extracellular Matrix Bioink for Investigating Hemodynamic Force-induced Endothelial Responses(기계적 강화 ECM 바이오잉크 기반 3D 동축 바이오프린팅을 활용한 협착 뇌혈관 및 혈류역학적 내피 반응 모델링)
- 논문 링크: https://doi.org/10.1002/adfm.202504276
[Abstract]
Hemodynamic Stress and Cerebrovascular Disease Modeling
Hemodynamic forces such as shear stress and disturbed flow play a crucial role in cerebrovascular diseases including atherosclerosis and stroke. However, existing in vitro models have limited ability to replicate pathological flow environments and the resulting endothelial responses. To address this challenge, the research team developed a physiologically relevant model of stenotic brain vessels capable of mimicking disease-specific flow dynamics and inflammation.
Embedded 3D Coaxial Bioprinting and Hybrid Bioink Development
The team applied an embedded 3D coaxial bioprinting technique to fabricate stenotic vascular structures with tunable inner diameters (250–500 μm). To enhance the mechanical stability of the vessels, a hybrid bioink was developed by combining vascular tissue-derived decellularized ECM (VdECM) with collagen and alginate. Rheological and mechanical testing demonstrated that this formulation achieved a ~65-fold increase in dynamic modulus compared to VdECM alone, enabling stable, perfusable vessel fabrication.
Replication of Pathological Flow and Endothelial Inflammation
Using computational fluid dynamics (CFD) simulations, the model reproduced disturbed flow conditions characteristic of stenotic regions, including areas of low shear stress and flow recirculation. When human endothelial cells (HUVECs and HBMECs) were cultured within the printed vessels, they formed functional barriers expressing junctional proteins such as CD31, ZO-1, and VE-cadherin. Under disturbed flow, inflammatory markers ICAM-1 and VCAM-1 were upregulated by ~2.2-fold and ~1.5-fold, respectively, confirming shear-induced endothelial activation.
Quantitative Platform for Disease Modeling and Drug Testing
This study establishes a quantifiable and reproducible platform for investigating the interplay between vascular geometry, hemodynamics, and cellular inflammation. Unlike traditional microfluidic systems, the bioprinted model allows for precise structural customization and the use of ECM-derived bioinks with tissue-specific properties. The platform can be further extended for personalized disease modeling, therapeutic screening, and implantable graft development.
Future Directions
The modular and scalable nature of this bioprinting system enables its application to a wide range of vascular disease models beyond the brain, including coronary and peripheral arteries. Future studies may focus on integrating immune cells, neurovascular components, and in vivo implantation to evaluate long-term functionality and translational potential.
- Authors (Pusan National University): · Byoung Soo Kim (School of Biomedical Convergence Engineering)
· Min-Ju Choi (Department of Biomedical Convergence Engineering)
- Title of original paper: Embedded 3D-Coaxial Bioprinting of Stenotic Brain Vessels with a Mechanically Enhanced Extracellular Matrix Bioink for Investigating Hemodynamic Force-Induced Endothelial Responses
- Journal: Advanced Functional Materials
- Web link: https://doi.org/10.1002/adfm.202504276
- Contact e-mail: bskim7@pusan.ac.kr
